今回は赤外分光・ラマン分光など分光分析を理解するために重要な電磁波とエネルギーの関係について書いていきます。
電子エネルギー準位、振動エネルギー準位、回転エネルギー準位などにも触れていきます。
基底状態と励起状態とは
分子中の電子は電磁波を吸収するとエネルギーの高い状態となり、外部に対し仕事をする能力を得ます。これを励起状態と呼びます。
励起状態になる前、つまりエネルギーの低い状態は基底状態と呼ばれます。
よって、基底状態の電子が光を吸収して励起状態になります。これを電子遷移と言います。
エネルギーの高い励起状態の電子はそのエネルギーを光として放出し、基底状態に戻ります。
電磁波は波と粒子の性質を持ちE = hvのエネルギーを持つ光子です。
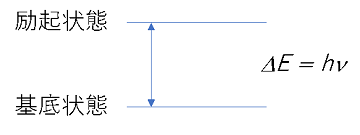
よって、基底状態と励起状態のエネルギーの差は
ΔE = hv
で表されます。hはプランク定数、vは振動数です。
電磁波とエネルギー・分光分析
紫外線、赤外線などは電磁波の1つでそれぞれ波長が異なります。波長は振動数から求められますね。紫外線は200~400 nm、赤外線は2000~15000 nmの電磁波です。
つまり、物質は基底状態と励起状態のエネルギー差に相当する電磁波と相互作用します。このエネルギーの差はエネルギー準位とも呼ばれます。
物質ごとに固有のエネルギーのエネルギー準位を持つため、これにより相互作用したエネルギーからどんな物質かを特定できるのです。
波長と相互作用の程度の関係を人間の目でもわかるように示した図をスペクトルと呼びます。このスペクトルからどんな物質かを分析していくのが分光分析です。
分子のエネルギー準位
分子には3つのエネルギー準位があります。
電子エネルギー準位、振動エネルギー準位、回転エネルギー準位です。
図を見てみましょう。
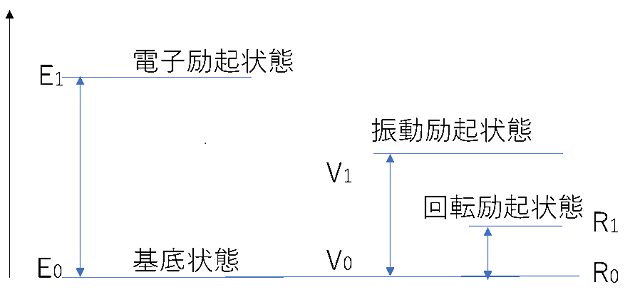
電子エネルギー準位はE、振動エネルギー準位はV、回転エネルギー準位はRで表されます。
電子エネルギー準位において励起状態で、電子が活発に動く状態を電子励起状態と言います。
振動エネルギー準位において励起状態のときは、電子は基底状態ですが、分子骨格が動いています。これを振動励起状態と言います。電子の動きは無いが、分子を構成する原子1つ1つが動いているイメージです。
回転エネルギー準位において励起状態では、電子、振動は共に基底状態ですが、分子自体が回転しています。これを回転励起状態と言います。
「おいおい!電磁波と相互作用するのは電子じゃないのか??なんで振動や回転が出てくるんだ?」
と混乱するかもしれませんが、回転や振動すると僅かですが電子も動きます。
つまり、光によって励起され電子が動いている。しかし、その程度は小さく振動や回転に収まっているため電子励起状態ほどのエネルギー準位ではない。と解釈できます。
上の図を見ると電子エネルギー準位に比べ振動、回転はエネルギー準位が小さいですよね??
これにより電子励起状態ほどではありませんが振動、回転でも電磁波と相互作用します。
先ほどの式E = hvより振動数が小さいほどエネルギー準位が小さいです。
つまり、相互作用する光の振動数によりエネルギー準位の大きさは変わり、Eの大きさにより電子励起状態、振動励起状態、回転励起状態のいずれかになることがわかります。


コメント