今回は化学平衡の基本について解説しようと思います。活性化エネルギーや反応速度定数などの用語も解説したいと思います。化学平衡を学ぶ上で知っておきたい考え方も書いています。
化学平衡って何?
結論を先に言っておきますと化学平衡とは正反応と逆反応の速度が等しくなった状態をです。つまり、反応による変化が止まっているように見えるんです。(あくまで見えるだけです。)
コップに水を入れラップをかけておいたとしましょう。
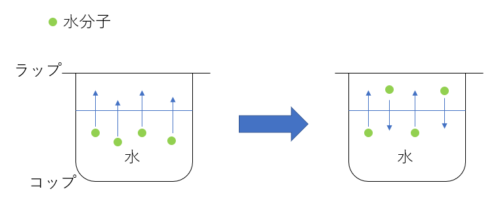
最初は水の蒸発が起こりコップの水が少し減りますが、その後はコップの水の量に変化がなくなります。
つまり、水面からの蒸発と気体の水分子が液体に戻る速さが等しくなっているんです!
こんな感じで、反応速度が等しくなり、見かけ上変化がないように見えることを化学平衡と言います。
以下で詳しく解説していきます。
可逆反応とは
まずはこちらの化学反応式をご覧ください。
aA + bB ⇄ cC + dD
A、B、C、Dは反応物、生成物を表しており、a、b、c、dは係数です。
2 molのA、1 molのBから、1 molのC、3 molのDが生成する場合は
2A + B ⇄ C + 3D
となります。
⇄を見たことがない人に説明しておきますと、これは正反応と逆反応を表しています。
上の式で説明すると、正反応は→の方向に進むAとBからCとDが生成する反応です。
また、逆反応は←の方向に進むCとDからAとBが生成する反応です。
このように正反応と逆反応が同時に起こるとき、その反応は可逆反応と言います。
活性化エネルギーとは?
化学反応が進行するとき活性化状態というエネルギー的に不安定な状態を経なければなりません。
この状態を超えるために必要なエネルギーを活性化エネルギーと言います。
反応速度と反応速度定数とは?
反応速度とは、化学反応の反応の速さです。
小学校で速度は(距離÷時間)と習いましたね。反応速度も同じです。
\[反応速度v = \frac{反応で変化した物質量(mol)}{反応にかかった時間(t)}\]
で表せます。しかし、化学反応の種類によって反応の速さが違うため、反応ごとに反応速度定数というものが決まっています。
A → Bという反応の反応速度定数をkとすると反応速度は
V = k[A]
と求めることができます。
最初に紹介した式
aA + bB ⇄ cC + dD
これの正反応の反応速度は反応速度定数をkfとすると
V = kf[A]a[B]b
と表せます。
これの逆反応の反応速度は反応速度定数をkbとすると
V = kb[C]c[D]d
と表せます。
平衡定数の求め方
aA + bB ⇄ cC + dD
この式の平衡定数Kは
\[K = \frac{[A] ^ a [B] ^ b}{[C] ^ c [D] ^ d}\]
となります。
どうしてこうなるんだよぉ!!となりますね。以下で説明します。
化学平衡とは正反応と逆反応の反応速度が等しくなることでしたね。
つまり、kf[A]a[B]b = kb[C]c[D]dが成り立ちます。
つまり、平衡定数Kは\[K = \frac{k _ f}{k _ b}\]
を計算することにより求めているのです。
よって、平衡状態では
\[K = \frac{[A] ^ a [B] ^ b}{[C] ^ c [D] ^ d}\]
が成り立ちます。



コメント